Constipación
crónica funcional en niños y su manejo en APS: una revisión bibliográfica.
Autor: Marcela
Cossio L. Monica Cuevas R. Internas de Medicina UCM.
Revisor: Dra
Francisca Rojas. Medicina familiar mención niño.
Fecha: 28 marzo, 2020
Resumen:
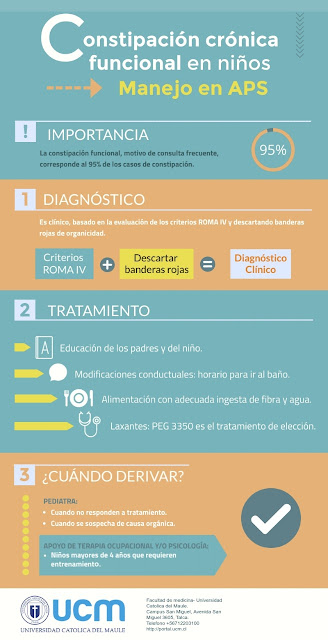
- La constipación es un motivo de consulta frecuente, donde la CF
corresponde al 95%.
- El diagnóstico es clínico basado en los criterios Roma IV.
- Las pruebas complementarias no tienen un rol en la evaluación de
rutina.
- Los pilares del tratamiento son educación, modificaciones
conductuales y dietarias y tratamiento farmacológico con PEG 3350.
- El tratamiento de estos pacientes es en APS, teniendo siempre
presente los criterios de derivación.
Introducción:
La constipación
infantil es un trastorno frecuente, con una prevalencia mundial de hasta 30%,
en donde la constipación funcional corresponde al 95% de los casos(1).
Constituye el 5% de las consultas pediátricas primarias y un 10-25% de las
consultas a gastroenterólogo(2). No existe información actualizada respecto a
nuestra realidad nacional.
Además del problema
médico, la CF altera la calidad de vida de los pacientes, demostrado en
diversos estudios que evalúan este compromiso mediante scores(13)
Etiología y diagnósticos relevantes:
La constipación es
una entidad clínica caracterizada por una disminución de la frecuencia de las
deposiciones(3). Puede dividirse en constipación funcional (CF) y constipación
de causa orgánica (CCO).
La CF o idiopática
es un fenómeno multifactorial, presentándose a menudo en eventos estresantes de
la vida del niño (transiciones dietéticas, entrenamiento para dejar los pañales
o inicio de la etapa escolar). Se explica por el paso de una evacuación dura y
dolorosa que genera miedo, provocando una conducta retencionista aprendida y un
círculo vicioso(3).
Las causas de CCO
se exponen en la Tabla 1.
Manejo en APS:
Evaluación
El diagnóstico
comienza con una anamnesis y examen físico completos. Los síntomas más comunes
son anorexia, dolor abdominal crónico y dolor defecatorio. Se debe determinar
si estamos frente a un paciente con CF o CCO. Para esto proponemos iniciar la
anamnesis preguntando por los criterios Roma IV para CF (Tabla 2) y continuar
por los signos de alarma de organicidad(Tabla 3).
En el examen físico
se debe descartar enfermedad orgánica. Además, se debe buscar fecaloma mediante
palpación abdominal y/o tacto rectal y fisuras anorectales debido al paso de
deposiciones grandes y duras.
Si se cumplen los
criterios ROMA IV y no existen signos de alarma estamos frente a un paciente
con CF.
Pruebas
complementarias como la ecografía y la radiografía abdominal no son útiles en
este trastorno(6). La evidencia indica que el diagnóstico de CF es clínico y no
necesita de pruebas de rutina.
Las pautas de
NASPGHAN y ESPGHAN, así como los
criterios ROMA IV enfatizan que la radiografía de abdomen no debe utilizarse de
rutina en los pacientes con CF(7), con algunas excepciones (Tabla 4).
Tratamiento en APS:
Recomendaciones:
¿qué dice la evidencia?
Educación: Educar a
los padres y al niño respecto a la fisiopatología de la CF y tranquilizar al
niño(12). Enfatizar que la encopresis es un fenómeno involuntario. Se debe
alentar en los padres una actitud de apoyo y establecer metas claras, indicando
que el manejo de la CF es a largo plazo(12). Recomendar el uso de un banquillo
para apoyar los pies que permita al niño una posición flectada al defecar, lo
cual facilita el proceso. Explicar a los padres que los laxantes no producen
dependencia, creencia que puede llevar a administrar dosis subterapéuticas.
Ingesta de fibra:
Se recomienda una alimentación con una ingesta adecuada de fibra. No existen
estudios que respalden una suplementación adicional(5). Es importante recalcar
una alimentación saludable en todos los pacientes.
Laxantes: El PEG
3350 es más efectivo que la
lactulosa y placebo como
tratamiento de desimpactación y mantenimiento, sin embargo, las dosis óptimas
necesitan mayor investigación (4). Se recomienda la lactulosa como alternativa
al PEG 3350(11)
Lactulosa: 1-3
ml/kg/día en 2 dosis diarias.
PEG 3350:
●
Dosis de desimpactación 1-1.5
g/kg/día por 3 días.
●
Dosis de mantenimiento 0.75
g/kg/día.
La duración del
tratamiento de mantención en niños con historial crónico de constipación es al
menos 6 meses. Para suspender el tratamiento, la constipación debe resolverse
al menos un mes antes(10).
Probióticos: Aumentan la frecuencia de las
deposiciones y disminuyen el dolor abdominal. Existe poca evidencia actual para
recomendar alguna cepa(5).
Modificaciones
conductuales: Se recomienda sentar al niño en el inodoro 5-10 min, 20-30 min
después de cada comida para aprovechar el reflejo gastrocólico, rutina que se
mantendrá hasta lograr deposiciones a intervalos normales durante 1 mes(1).
Promover las deposiciones cuando se produzca necesidad es fundamental para un
tratamiento exitoso a largo plazo.
Respecto a la
medicina alternativa:
El glucomanano y la
melaza negra han demostrado
aumentar significativamente la frecuencia defecatoria y disminuir el dolor
asociado a defecación en niños con CF(8). Ambos están disponibles en Chile en
farmacias naturistas.
La acupuntura
produce una mejoría significativa en la frecuencia defecatoria de niños con CF,
mientras que el masaje abdominal evidencia una mejoría significativa en la
calidad de vida y una menor necesidad de uso de laxantes(8).
Lo nuevo:
estimulación eléctrica transcutánea (EET): es una terapia adyuvante emergente para pacientes con CF
refractarios, sin embargo, los estudios disponibles son escasos. Aún no se
puede precisar los beneficios de la EET en la CF(9).
¿Cuando derivar?:
Niños mayores de 4
años se beneficiarían de apoyo de terapia ocupacional y /o psicológica para
entrenamiento(10).
Se recomienda
derivar a pediatría a aquellos niños con CF que luego de 6 meses de adecuado
tratamiento siguen necesitando fármacos para lograr un adecuado hábito
defecatorio, aquellos que no responden a tratamiento y ante sospecha de causa
orgánica(10)
Conclusiones:
La CF altera la calidad de vida de los niños. Si
bien en Chile no se encuentran datos actuales de prevalencia, es un motivo de
consulta frecuente en APS. Es importante realizar una anamnesis y examen físico
orientados a descartar causas secundarias, sin necesidad de exámenes
complementarios de rutina. Los pilares del manejo en APS son una correcta
educación, modificaciones conductuales, tratamiento farmacológico con laxantes
y una dieta rica en fibras y agua. Existen alternativas en la medicina
tradicional con evidencia en el tratamiento de la CF. El manejo de estos niños
es en APS, teniendo siempre presente cuándo se debe derivar a nivel secundario.
Referencias:
- Kevin A. Jiles BS & Miller C. Hamrick
MD. (2017). Evaluation and
Management of Pediatric Constipation. Marzo 10,
2020 , de Springer Sitio web: https://link.springer.com/article/10.1007/s40746-017-0078-8?shared-article-renderer
- Torres, A,.& González.M. (2015). Constipación crónica. Marzo 10, 2020, de Revista Chilena de
Pediatria Sitio web: https://www.elsevier.es/es-revista-revista-chilena-pediatria-219-pdf-S0370410615001059
- Avelar,D., Toro, EM.,& Ramírez JA.(2018). Constipación funcional en pediatría: Criterios de Roma IV,
diagnóstico y tratamiento. Marzo 10, 2020, de Scielo Sitio web: http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0186-23912018000100081&lng=es&nrm=iso
- Gordon, M., MacDonald, J., Parker, C.,
Akobeng, A., & Thomas, A,.. (2016).
Osmotic and stimulant laxatives for the management if childhood
constipation. Marzo 9,2020, de Cochrane Sitio
web: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009118.pub3/full/es
- Southwell, B.. (2020). Treatment of Childhood Constipation: a
synthesis of systematic reviews and meta-analyses.. Marzo 10, 2020, de
Expert Review of Gastroenterology & Hepatology Sitio web: https://www.tandfonline.com/doi/abs/10.1080/17474124.2020.1733974
- Beinvogl,B., Sabharwal, S., McSweeney, M.,
& Nurko,S.. (2017). Are We Using
Abdominal Radiographs Appropriately in the Management of Pediatric
Constipation?. Marzo 8,2020, de The Journal of Pediatrics Sitio web: https://www.jpeds.com/article/S0022-3476(17)31156-3/fulltext
- Jiles, K., & Hamrick, M.. (2017). Evaluation and Management of Pediatric
Constipation. Marzo 8, 2020, de Research Gate
Sitio web: https://www.researchgate.net/publication/316655310_Evaluation_and_Management_of_Pediatric_Constipation
- Paknejad , Motaharifard, Barimani , Kabiri
,& Karimi.. (2019). Traditional,
complementary and alternative medicine in children constipation: a
systematic review.. Marzo 9, 2020, de DARU
Journal of Pharmaceutical Sciences Sitio web: https://www.springer.com/journal/40199
- Terng, R., Seah Lee, W., Lee, H., Ming,
K., Ian, Y., & Lai,N.. (2016).
Transcutaneous electrical stimulation (TES) for treatment of constipation
in children. . Marzo 8,2020, de Cochrane Library
Sitio web: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010873.pub4/full/es
- Singh, H., & Connor, F.. (2018). Paediatric constipation: An approach
and evidence-based treatment regimen. Marzo 12,2020, de Australian
Journal of General Practice Sitio web: https://www1.racgp.org.au/ajgp/2018/may/paediatric-constipation/
- Salem Shatnawi,M., Mu’azi Alrwalah, M.,
Majed Ghanma,A.,Lutfi Alqura’an, A., Nequla Zreiqat, E., & Alzu’bi, M.
. (2019). Lactulose versus
polyethylene glycol for disimpaction therapy in constipated children, a
randomized controlled study. Marzo 14,2020, de Sudanese Journal of
Paediatrics Sitio web: https://www.ejmanager.com/mnstemps/106/106-1546805996.pdf?t=1584847907
- Madani,S., Tsang,L., & Kamat,D..
(2016). Constipation in Children: A
Practical Review. Marzo 16,2020, de Pediatric
annals Sitio web: https://search.proquest.com/openview/3a32caefcf8365c1cf22bc992f84fd3a/1?pq-origsite=gscholar&cbl=34609
- Vriesman, M., Koppen, I., Etten-
Jamaludin,F., Dijk, M, Devanarayana, N., Tabbers, M., & Benninga,M..
(2019). Quality of Life in Children
with Functional Constipation: A Systematic Review and Meta-Analysis.
Marzo 10,2020, de The Journal of Pediatrics Sitio web: https://www.jpeds.com/article/S0022-3476(19)30823-6/abstract